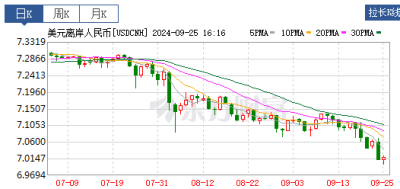
 該建議主要基於Adakveo預防SCD患者血管閉塞性危象(VOC)的III期STAND(NCT03814746)研究結果。與安慰劑相比,Adakveo在兩種不同劑量(5.0mg/kg,7.5mg/kg)水平下均未能降低VOC的發生率。 諾華表示,歐盟不會有新患者接受crizanlizumab治療。對於目前使用crizanlizumab的患者,醫療保健人員應與他們討論替代治療方案。 Crizanlizumab是一種人源化單克隆抗體,可與P-選擇素結合發揮治療作用。P-選擇素是一種在血管內皮細胞和血小板表面發現的蛋白質,主要引起細胞間相互作用,參與血栓形成或鐮刀細胞病相關疼痛危象。 2016年11月,諾華以6.65億美元收購Selexys Pharmaceuticals獲得了crizanlizumab的所有權。2019年11月,crizanlizumab獲FDA批准上市,用於降低16歲以上SCD患者VOC的發生頻率,商品名爲Adakveo。2020年10月,該產品進入了歐盟市場。市場表現方面,該產品2022年銷售額爲1.94億美元。
該建議主要基於Adakveo預防SCD患者血管閉塞性危象(VOC)的III期STAND(NCT03814746)研究結果。與安慰劑相比,Adakveo在兩種不同劑量(5.0mg/kg,7.5mg/kg)水平下均未能降低VOC的發生率。 諾華表示,歐盟不會有新患者接受crizanlizumab治療。對於目前使用crizanlizumab的患者,醫療保健人員應與他們討論替代治療方案。 Crizanlizumab是一種人源化單克隆抗體,可與P-選擇素結合發揮治療作用。P-選擇素是一種在血管內皮細胞和血小板表面發現的蛋白質,主要引起細胞間相互作用,參與血栓形成或鐮刀細胞病相關疼痛危象。 2016年11月,諾華以6.65億美元收購Selexys Pharmaceuticals獲得了crizanlizumab的所有權。2019年11月,crizanlizumab獲FDA批准上市,用於降低16歲以上SCD患者VOC的發生頻率,商品名爲Adakveo。2020年10月,該產品進入了歐盟市場。市場表現方面,該產品2022年銷售額爲1.94億美元。
追加內容
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:CHMP建議撤回諾華鐮狀細胞病藥物Adakveo上市許可
地址:https://www.twetclubs.com/post/7857.html