近年來,非小細胞肺癌(NSCLC)靶向治療的發展突飛猛進,也开始有更多突變基因的靶向藥湧現。RET是NSCLC的罕見靶點,隨着基因檢測技術的進一步發展,驅動RET基因也被篩查出來,從發現RET基因突變,到有特異性的抑制劑可用,至今經歷了十年的時間,終是讓“罕見”被大衆“看見”。
塞普替尼是全球首款獲批的高選擇性RET抑制劑,通過抑制異常RET激酶的活性而發揮作用。自去年10月在中國獲批,到如今正式商業化上市,塞普替尼在信達生物手裏終於迎來了商業價值綻放。
1
塞普替尼的獲批歷程
塞普替尼(睿妥)由禮來制藥研發,是自2019年禮來以約80億美元收購Loxo Oncology獲得的抗癌靶向藥當中的核心資產之一。
塞普替尼分子結構式
來源:藥論網
2020年5月,塞普替尼獲得美國FDA批准上市,成爲全球首個獲批的高選擇性RET抑制劑。
2021年11月,爲了拓展中國市場,禮來向中國國家藥品監督管理局藥品審評中心(CDE)提交了塞普替尼的上市申請,該申請被納入優先審評審批程序,加速了塞普替尼在中國的獲批進程,塞普替尼踏出了“中國之行”的第一步。
2022年3月,信達生物從禮來獲得塞普替尼在中國的獨家商業化權利,全權負責塞普替尼的定價、進口、營銷、分銷和銷售推廣,信達正式成爲塞普替尼“中國之行”的“護花使者”。
2022年9月,塞普替尼獲國家藥監局批准。用於治療轉染重排基因(RET)融合陽性的轉移性非小細胞肺癌(NSCLC)的成年患者,和需要系統性治療的攜帶RET突變的晚期或轉移性甲狀腺髓樣癌成人和12歲及以上的兒童患者,以及需要系統性治療和放射性碘治療(如適用)難治的RET融合陽性的晚期或轉移性甲狀腺癌成人和12歲及以上的兒童患者,塞普替尼正式落地中國。
2022年9月,FDA批准塞普替尼作爲首個且唯一RET抑制劑,不限癌種用於RET基因融合的晚期或轉移性實體瘤成人患者,同時常規批准該藥用於RET融合陽性的局部晚期或轉移性非小細胞肺癌成人患者。
2023年3月4日,信達生物开始面向全國供藥,這不僅標志着RET變異非小細胞肺癌和甲狀腺癌患者迎來新的治療選擇,同時標志着中國精准醫療的又一裏程碑。
2023年3月6日,信達生物正式發布新聞稿,塞普替尼已在中國商業化上市。至此,塞普替尼正式开啓中國之行。
藥品不是簡單的面包和雞蛋,獲得藥監局審批上市,只是“萬裏長徵”的第一步。對於任何一家生物制藥企業來說,將產品做上市不是目的,產品真正能夠在市場上換來“真金白銀”,成功商業化才是各家見真章,畢竟“好產品便是硬通貨”。
據了解,近期,信達生物公布塞普替尼在已經上架銷售的部分藥店公开零售價(不考慮優惠贈藥等福利)爲:32833.5元(80mg*56粒/盒)。通常全國都是統一零售價或差別不大。自公布塞普替尼正式商業化上市喜訊,信達生物在資本市場持續活躍,其股價已連漲多日。
此次塞普替尼正式商業化上市,已在換取“真金白銀”的路上,於禮來,可謂爲塞普替尼在中國找到“好歸宿”,於信達,再一次向大衆展現其數一數二的商業化能力。
2
趨於“一线”的商業化能力
如果將一家生物醫藥企業比作“馬車”,創新能力就是前行領路的馬,而商業化能力就是保證馬車持續向前的車輪,兩者都不應該被忽視。信達生物的商業化團隊無論規模還是經驗,都算得上是中國生物醫藥企業的佼佼者,與百濟神州同在國內藥企商業化能力的第一梯隊。
信達生物擁有比較完整的銷售體系,商業化方面,信達生物也處於中國生物制藥企業的“超一线”,經過多年的發展,信達逐漸具備高效、持續、成體系化的商業化能力。目前擁有超過3000人的營銷團隊,核心管理人員深耕中國的腫瘤藥市場多年,擁有豐富的市場經驗和深厚的市場根基,助力信達生物數個商業化產品在市場中乘風破浪。

來源:信達生物官網
信達生物的商業化能力也已經被市場證明,2020年、2021年、2022年上半年,信迪利單抗營收分別爲3.08億美元、4.18億美元、1.59億美元。以及PD-1產品銷售增長,都備受市場關注;雖然由於“以價換量”醫保談判讓信迪利單抗的銷售情況在2022年遭遇到前所未有的壓力,但商業化團隊依然保留着終端渠道的資源,據悉,信達銷售團隊人均上半年銷售收入超過74萬元,始終居於商業化成績前列。
此外,2022年8月,賽諾菲與信達生物圍繞兩款產品“零首付”合作,着實聚焦業界關注,也讓大衆看到了信達商業化團隊具備的優勢。
截止目前,信達生物已推動了8款產品的商業化,包括達伯舒(信迪利單抗)、達攸同(貝伐珠單抗)、蘇立信(阿達木單抗)、達伯華(利妥昔單抗)、達伯坦(佩米替尼)、耐立克(奧雷巴替尼,亞盛醫藥合作產品)、希冉擇(雷莫西尤單抗)、睿妥(塞普替尼)。
禮來多年“鐘情”於信達生物,多半得益於信達趨於成熟的商業化能力。正如禮來中國區總裁所述:“基於我們在過往和信達生物的成功合作,以及信達生物在和禮來共同开發和商業化信迪利單抗所建立起的良好商業化能力,我們認爲這次將塞普替尼授權給信達生物是一個非常好的做法,和信迪利單抗有很強的互補性。”
3
長達8年的合作
衆所周知,禮來是一家全球性以研發爲基礎的醫藥公司,擁有130年歷史的世界領先制藥公司,自1993年重返中國市場,至今與中國市場結下了近三十年的不解之緣。而信達生物成立於2011年,是一家致力於开發、生產和銷售用於治療腫瘤等重大疾病的創新藥物的中國藥企,自成立以來,憑借創新成果和國際化的運營模式在衆多生物制藥公司中脫穎而出。
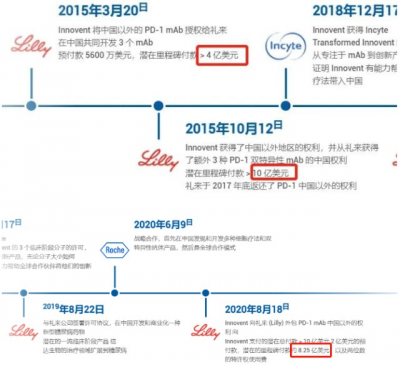
信達與禮來堪稱醫藥界一對模範搭檔,此次禮來牽手信達完成塞普替尼中國市場的商業化,並非兩家公司的第一次合作,追根碩源,兩者的第一次“結合”發生在8年前。
2015年3月,信達生物與禮來就首次宣布在腫瘤領域達成合作,包括將在中國共同开發和商業化信迪利單抗,首付款達到2億美元,這在當時曾創下中國藥企對外授權合作的金額記錄。
2019年8月,信達生物與禮來還將合作延伸至糖尿病領域,信達生物獲授權在中國开發和商業化禮來的一個潛在全球最佳新型臨牀階段糖尿病藥物。
2020年8月,禮來與信達生物進一步擴大信迪利單抗的合作範圍。禮來以10.25億美元的首付款+裏程碑費用以及銷售雙位數分成,獲得PD-1抑制劑信迪利單抗在中國以外地區的獨家許可。禮來一次性支付的首付款,之後信達生物還會陸續收到銷售裏程碑付款,以及產品上市後每年雙位數的銷售分成。
2021年3月,FDA拒絕了信迪利單抗用於治療新診斷的非鱗狀非小細胞肺癌的上市申請,並批評禮來僅使用了信迪利單抗在中國地區進行的關鍵臨牀數據,將實驗療法與過時的方案進行比較。雙方的合作也正面臨巨大的考驗,也因此信達生物未獲得任何潛在裏程碑付款。同年12月禮來對外透露,在中國的PD-1銷售團隊將收縮,這是兩個公司在合作了長達六年的時間裏第一次遺憾分手。
2021年1月起,信達生物與禮來也重新對信迪利單抗在國內的銷售進行了安排。據悉,目前信迪利單抗在國內市場的推廣也已經全部交給信達生物來完成。經歷短暫分手,雙方重新“牽手”。
2022年3月,禮來和信達生物共同宣布雙方將深化战略合作,並達成兩項合作協議:禮來授予信達生物在中國大陸進口、銷售、推廣和分銷雷莫西尤單抗和塞普替尼獲批後獨家商業化權利,以及授予信達生物享有塞普替尼未來在中國大陸商業化權利的優先談判權。
8年時間,信達生物與禮來攜手了5次,分分合合間兩家公司的合作交易已超過25億美元。
信達與禮來的合作,
來源:bioSeedin柏思薈
從市場角度來看,國內藥企與跨國藥企間的分分合合都已成爲業內常態,這也是一種雙贏的模式。回顧攜手的八年,禮來對於信達生物的可謂是“不離不棄”,信達生物對於禮來回敬的是“生死相依”的堅定。
結 語
信達生物攜手禮來,通力合作,推進塞普替尼在中國正式商業化上市,不僅是禮來在中國腫瘤領域順利开疆拓土的又一印證,同時也是信達生物與禮來战略合作的又一成功,更是爲中國RET融合陽性NSCLC患者帶來更多生存獲益。
時至今日,信達生物已是中國生物制藥企業的“領跑者”,正努力向着“全球領先的生物制藥公司”進軍,相信禮來與信達生物未來還會一起創造更多合作战績,畢竟成功密碼,向來是強強聯合,路才會越走越遠。
參考資料:
1、信達生物官網
2、《合作總交易超25億美元!信達與禮來再度攜手,深耕腫瘤小分子及抗體藥开發》bioSeedin柏思薈,2022年3月28日
3、《禮來退還信達生物PD-1單抗》抗體圈,2022年12月3日
4、《信達與賽諾菲“零首付”合作,疊加高管離職、架構調整獲高度關注!信達獨家回應:不存在現金流壓力!》醫藥經濟報,2022年8月8日
5、《禮來RET抑制劑在華獲批上市,信達擁有商業化權益》醫藥魔方,2022年10月9日
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:跨國藥企合作雙贏模式:信達攜手禮來,塞普替尼終迎商業收獲期
地址:https://www.twetclubs.com/post/1658.html